TIGIT抑制剂的研究进展
0
1
发现历史
TIGIT(也称为WUCAM,Vstm3,VSIG9)是脊髓灰质炎病毒受体(PVR)/粘连蛋白(nectin)家族的一员,PVR属于免疫球蛋白超家族。
2009年,Xin Yu等人在筛选特定表达于T细胞中具有代表性免疫调节受体蛋白结构域结构的基因时,发现了一个T细胞和NK细胞特定表达的基因,其编码包含一个免疫球蛋白可变结构域(IgV),一个跨膜结构域和一个免疫受体基于酪氨酸的免疫受体抑制性基序,称之为TIGIT(T cell immunoglobulin and ITIM domain)。

▲图1.TIGIT的结构
其结构由3部分组成(如图1所示): 1个细胞外免疫球蛋白V样结构域(IgV 结构域) ,1个I型跨膜域和1个由基于酪氨酸的免疫受体抑制性基序( immuno receptor tyrosine-based inhibitory motif, ITIM) 及免疫球蛋白酪氨酸尾部( immunoglobulin tyrosinetail, ITT) 样基序组成的短细胞内结构域。
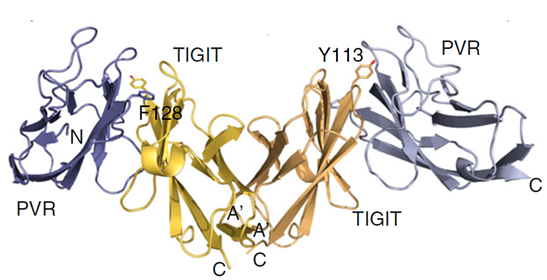
TIGIT的配体主要是PVR家族成员,如CD155和CD112,对CD155亲和力更高。TIGIT可以CD226竞争性地结合CD155,但是TIGIT与CD155(Kd=1-2nM)的亲和力高于CD226(Kd=119nM)。TIGIT与配体结合时(如图2所示),首先形成同源二聚体,每个TIGIT通过IgV 结构域的锁-钥结构与配体反向结合,形成顺-反异四聚体,介导细胞间的粘附和信号。
0 3 分布及功能
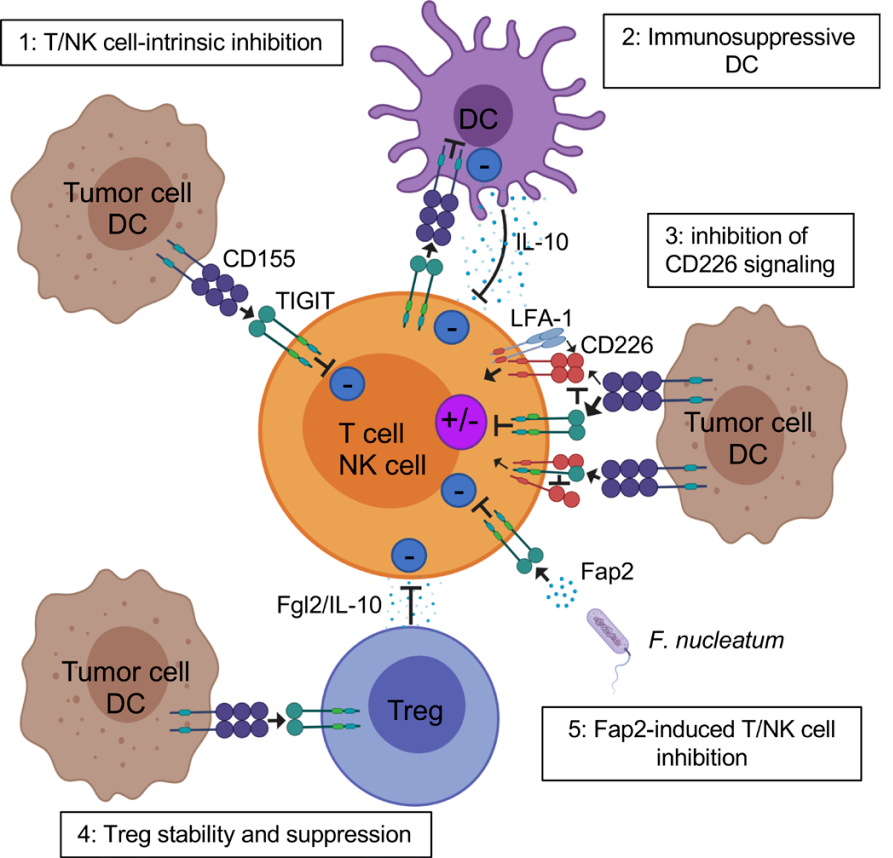
TIGIT在CD4+T细胞、CD8+T细胞、NK细胞和Treg细胞中表达,通过多种机制抑制固有免疫和适应性免疫(如图3所示)。
▲图3.TIGIT的功能
1. TIGIT能够与DC细胞上的CD155结合,磷酸化CD155,诱导IL-10的生成和减少IL-12的生成,直接抑制T细胞。
2. TIGIT抗体通过减弱 T 细胞受体 (TCR) 驱动的激活信号来抑制 T 细胞增殖和功能。
3. TIGIT能够抑制CD155介导的CD226激活。CD226是表达与各个免疫细胞中的共刺激因子,能够与CD155和LFA-1结合,参与TCR信号通路激活和T细胞和NK细胞肿瘤识别。TIGIT一方面由于其与CD155有更高的亲和力,通过与CD226竞争性结合CD155,阻止CD226激活;另一方面,TIGIT能直接与CD226顺式结合,阻止其同型二聚,使CD226无法与CD155结合。
4. TIGIT能够抑制NK细胞的功能。在人NK细胞系YTS中,TIGIT/CD155 结合后,通过 ITT 样基序启动主要抑制信号,而 ITIM 基序介导次要抑制信号。ITT 样基序在 Tyr225 和 Grb230 和β-抑制蛋白招募含有 SH2 的肌醇磷酸酶-1(SHIP-1)。SHIP-1 阻碍磷酸肌醇 3 激酶和MAPK信号传导。SHIP-1 还损害TRAF6 和 NF-κB 的活化,抑制 NK 细胞产生干扰素 (IFN)-γ。而ITIM 基序可被Src家族激酶磷酸化,募集并激活包含SH2 的蛋白质,传递抑制性受体信号从而削弱NK 细胞的杀伤功能,干扰NK 细胞释放溶解颗粒。此外,具核梭杆菌的 Fap2 蛋白可以直接与 TIGIT 结合,抑制 NK 细胞。
5. TIGIT还可增强Tregs 的免疫抑制功能,TIGIT 位点甲基化水平降低以及与Foxp3 结合导致Tregs 表达TIGIT水平升高。TIGIT 表达水平升高的Tregs 诱导IL-10 和纤维蛋白原样蛋白2( Fgl2) 的产生并作用于T 细胞产生抑制作用。
TIGIT在黑色素瘤、NSCLC、结肠癌、HCC、胃癌、胶质母细胞瘤和血液系统恶性肿瘤中的人肿瘤浸润 CD8+T 细胞、NK 细胞、Th 和 Treg 细胞中都有表达。多项研究发现,肿瘤内 TIGIT+CD4+和 CD8+T 细胞数量的增加与滤泡性淋巴瘤患者较差的患者预后和较差的存活率有关;外周 CD8+T 细胞上的高 TIGIT 表达与急性髓性白血病 (AML) 患者的原发性难治性疾病相关,TIGIT在癌症患者的抗肿瘤免疫中具有抑制作用。理论上TIGIT抑制剂可以用于肿瘤的治疗,增强机体抗肿瘤作用。
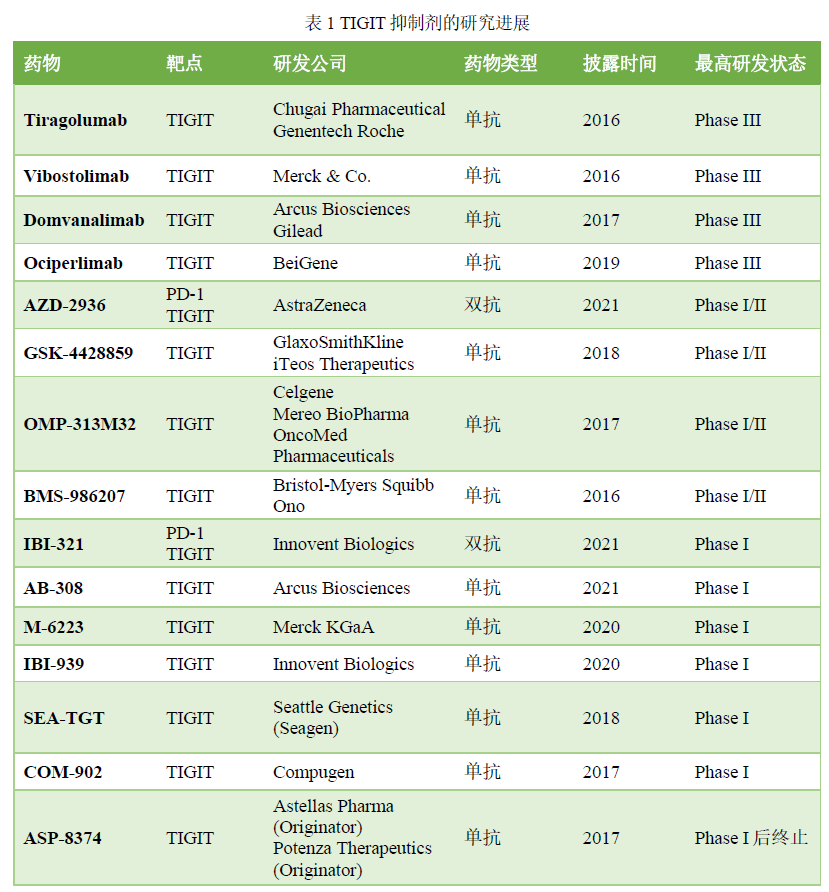
目前,共有15个靶向TIGIT新药项目进入了临床研究阶段(如表1所示)。整体从药物类型可分为单抗(11个)和双抗(2个)。进展最快的是Ociperlimab、Domvanalimab、Vibostolimab和Tiragolumab,已进入3期临床。下面就进入3期临床的药物进行介绍。
01Tiragolumab
Tiragolumab是由罗氏子公司基因泰克研发的人源化抗TIGIT单克隆抗体。自2016年起,罗氏针对Tiragolumab开展了25项临床试验(如图4,5,6所示),2期临床试验数最多,3期临床试验次之,多数试验处于招募中,有两项临床试验已经完成(NCT03563716,JapicCTI-195013),适应症以非小细胞肺癌(27%)和小细胞肺癌(11%)为主。在2020年的 ASCO 大会上,罗氏公布了 Tiragolumab 与 PD-L1 抑制剂 Atezolizumab 联用治疗非小细胞肺癌的二期临床试验(CITYSCAPE,NCT03563716)的结果。CITYSCAPE结果显示(如表2所示),在PD-L1高表达人群中,Tiragolumab与Tecentriq联用相较Tecentriq单药治疗能够显著提高患者的ORR和PFS。与此同时,Tiragolumab与Tecentriq联用时,安全性与Tecentriq单药相似,无新的不良反应。受此鼓舞,罗氏继续开展了联合用药的治疗非小细胞肺癌的三期临床试验。今年一月,Tiragolumab获得了FDA突破性疗法和孤儿药资格认定。
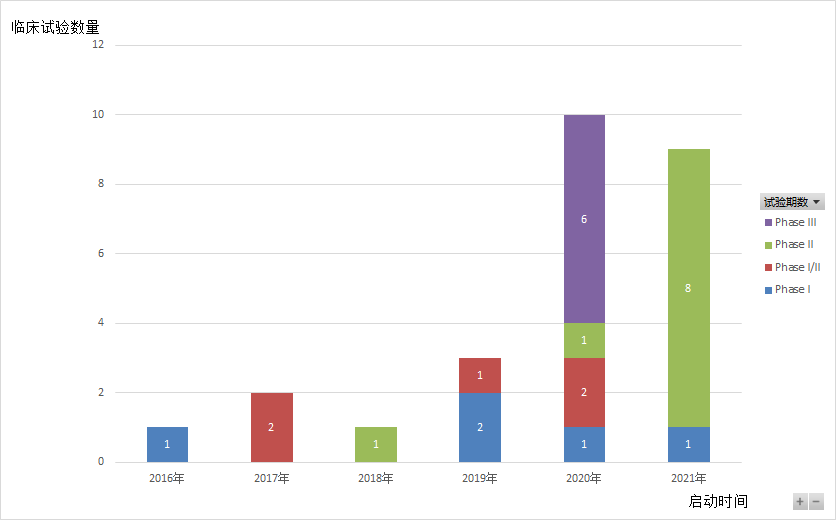
▲图4.Tiragolumab临床试验每年的分布数量
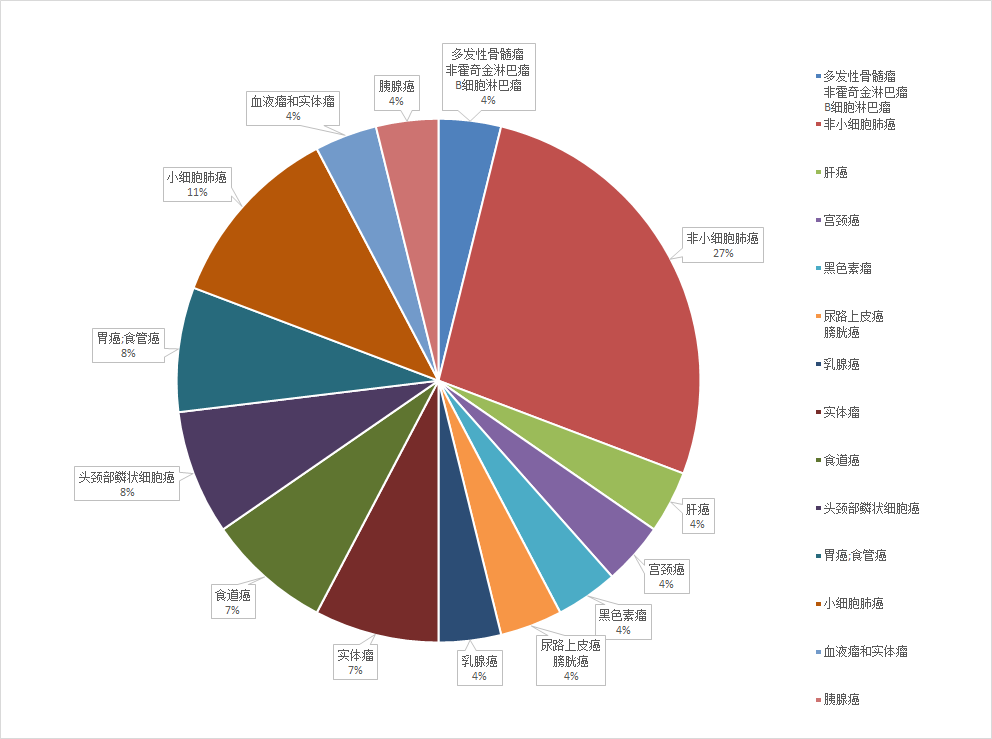
▲图5.Tiragolumab临床试验适应症分布
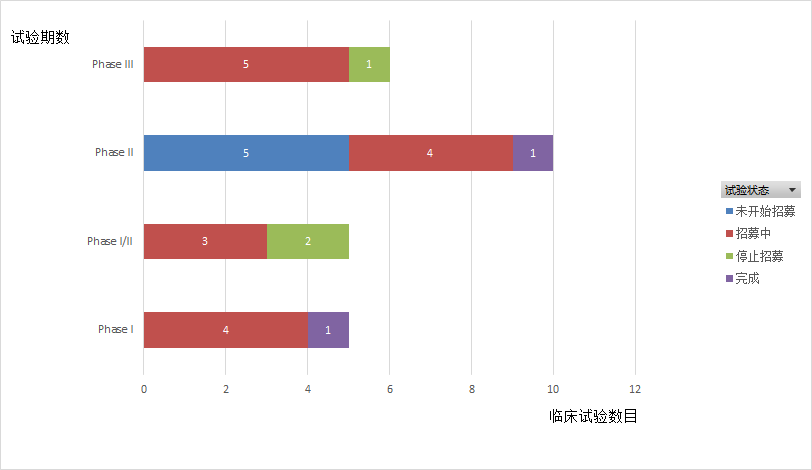
图6.Tiragolumab临床试验状态分布
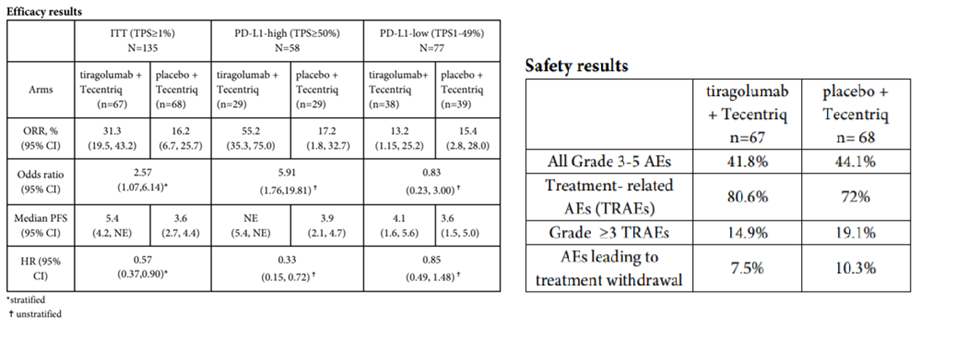
表2.CITYSCAPE的临床结果
02Vibostolimab
Vibostolimab是由默克公司研发的靶向TIGIT的人鼠嵌合单克隆抗体。从2016年起,默克启动了5项临床试验,均在招募中(如图7,8,9所示)。其中3项试验(Substudy02A、02B、02C)为 1/2 期 KEYNOTE-U02 伞形临床试验的子研究,在2020年ESMO大会上,默沙东公布了I期试验B部分的数据,该试验评估了vibostolimab联合Pembrolizumab治疗此前未接受过PD-1/PD-L1疗法,但至少接受过一种其他疗法的转移性NSCLC患者安全性和疗效。临床结果显示,Vibostolimab 与 Pembrolizumab联用在未接受抗 PD-1/PD-L1 治疗的 NSCLC 患者中显示出良好的抗肿瘤活性和安全性。在所有入组患者中,vibostolimab联合 Pembrolizumab治疗的 ORR 为 29%,中位 PFS 为 5.4 个月。未达到中位 DOR。在肿瘤表达 PD-L1(TPS≥ 1%)的患者中,ORR 为46%,中位 PFS 为 8.4 个月(95% CI, 3.9-10.2)。在肿瘤表达 PD-L1(TPS <1%)的患者中,ORR 为 25%,中位 PFS 为 4.1 个月。联合治疗组的TRAEs发生率为83%,常见不良反应是瘙痒 (34%)、低白蛋白血症 (29%) 和发热 (20%)。目前。默克公司正在启动Vibostolimab治疗NSCLC患者的III期临床试验。同时也正在进行MK-7684A(Vibostolimab和Pembrolizumab的复方注射液)治疗NSCLC患者的III期临床试验(NCT04738487)。
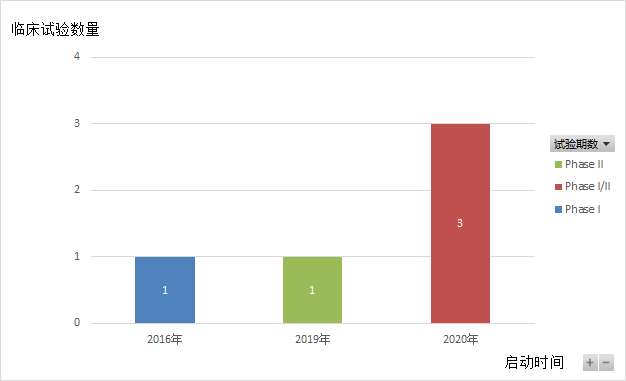
图7.Vibostolimab临床试验每年的分布数量
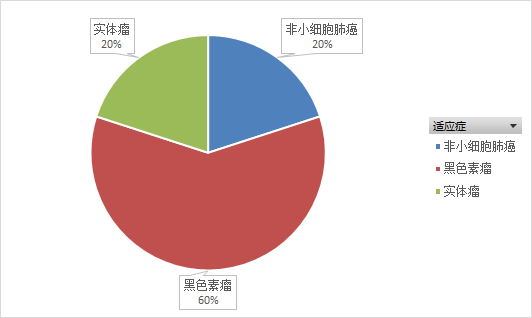
图8.Vibostolimab临床试验适应症分布
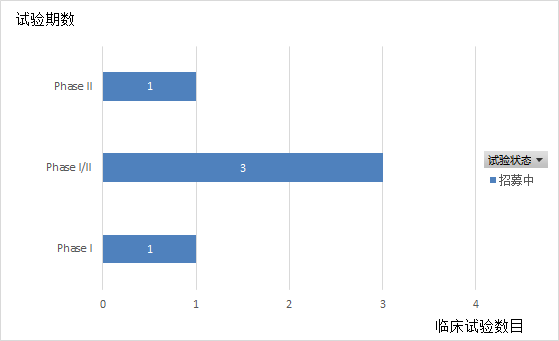
图9.Vibostolimab临床试验状态分布
03Domvanalimab
Domvanalimab是Arcus Biosciences公司研发的Fc沉默的抗TIGIT单克隆抗体。截至目前,Arcus Biosciences已就Domvanalimab开展了5项临床试验(如图10,11,12所示),均处于招募中,适应症以非小细胞肺癌为主。2021年6月,Arcus Biosciences召开了投资者电话会议,会议中提及了ARC-7(NCT04262856)的临床进展。ARC-7是一项评估Zimberelimab单药、Zimberelimab和Domvanalimab联用、Zimberelimab和Domvanalimab及etrumadenant联用,用于治疗PD-L1 阳性、局部晚期或转移性非小细胞肺癌。中期数据显示,使用Domvanalimab能够提高临床疗效,也没有新的不良反应事件。
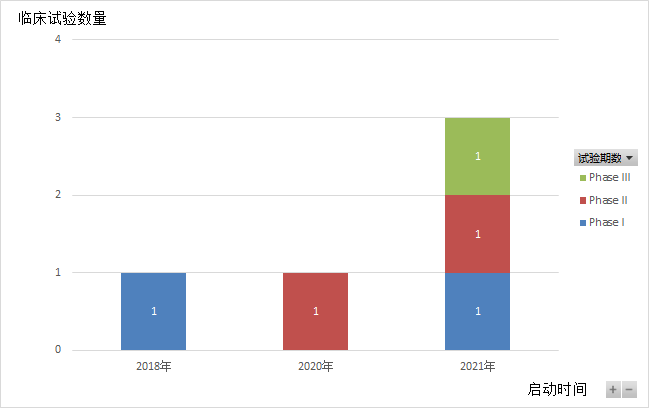
图10.Domvanalimab临床试验每年的分布数量
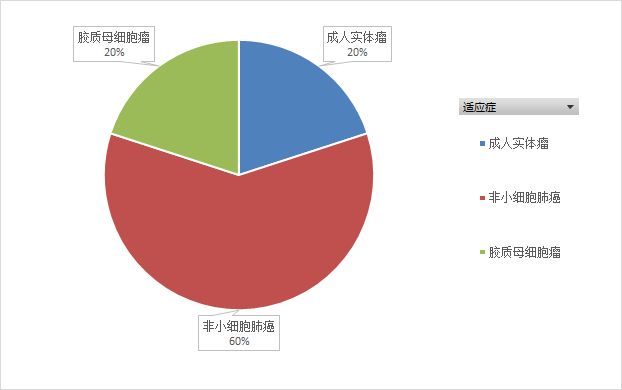
图11.Domvanalimab临床试验适应症分布
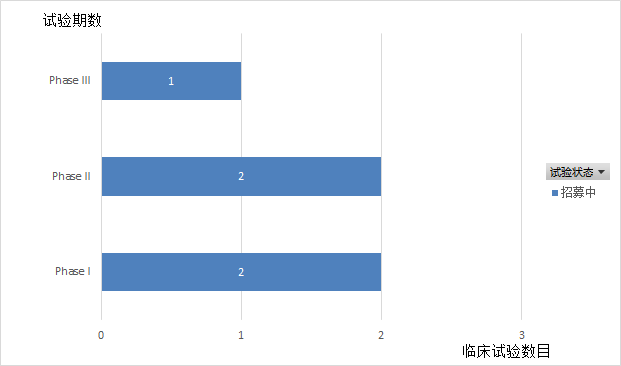
图12.Domvanalimab临床试验状态分布
04Ociperlimab
Ociperlimab是由百济神州研发的抗TIGIT的人源化单克隆抗体。从2019年起,百济神州在全球启动了10项临床试验(如图13,14,15所示),主要为II期临床试验,适应症主要为非小细胞肺癌(30%)和食管鳞状细胞癌(20%),多数试验还处于招募中,尚未有试验完成。
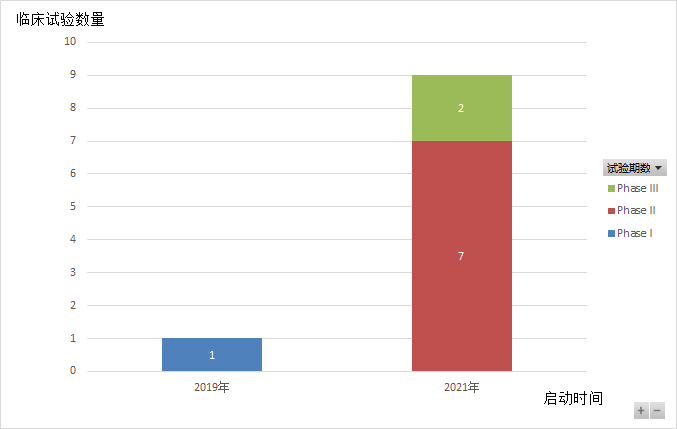
图13.Ociperlimab临床试验每年的分布数量
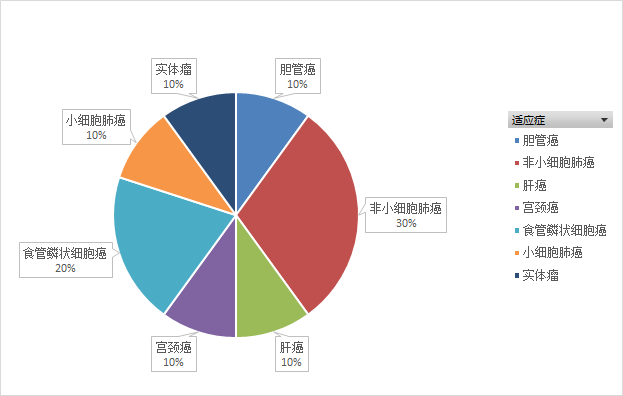
图14.Ociperlimab临床试验适应症分布
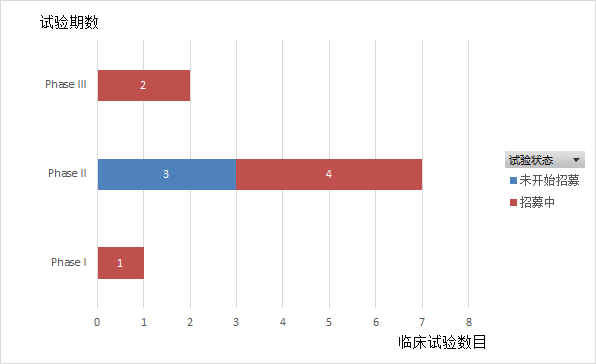
图15.Ociperlimab临床试验状态分布
TIGIT在体内主要发挥免疫抑制的功能,因此抑制TIGIT有可能增加机体的抗肿瘤作用。目前的临床研究集中于PD-1/PD-L1单抗和TIGIT单抗联用治疗非小细胞肺癌。从Tiragolumab的临床试验结果来看,TIGIT单抗能够加强PD-L1单抗的抗肿瘤活性,安全性尚可,TIGIT单抗获批上市指日可待。
参考文献:
[1] Yu X, Harden K, Gonzalez LC, et al. Thesurface protein TIGIT suppresses T cell activation by promoting the generationof mature immunoregulatory dendritic cells. Nat Immunol. 2009; 10(1): 48-57.
[2] Stengel KF, Harden-Bowles K, Yu X, etal. Structure of TIGIT immunoreceptor bound to poliovirus receptor reveals acell-cell adhesion and signaling mechanism that requires cis-trans receptorclustering. Proc Natl Acad Sci U S A. 2012; 109(14): 5399-5404.
[3] Chauvin JM, Zarour HM. TIGIT in cancerimmunotherapy. J Immunother Cancer. 2020; 8(2): e000957.
[4] 卢惠, 王华芳. 免疫检查点分子TIGIT在血液恶性肿瘤中的研究进展[J]. 中国实验血液学杂志, 2021, 29(03): 993-997.
[5] Ge Z, Peppelenbosch MP, Sprengers D,Kwekkeboom J. TIGIT, the Next Step Towards Successful Combination ImmuneCheckpoint Therapy in Cancer. Front Immunol. 2021; 12: 699895.
智慧芽生物医情报库
新资讯 新技术 新靶点 竞争格局