2021年第四季度,欧易生物单细胞测序客户文章持续井喷,据不完全统计,第四季度目前已经接受了10+篇客户文章。在这些客户文章中,今天为大家带来的这篇尤为特殊,该研究使用了单细胞转录组与单细胞ATAC双平台深度解析了小鼠胸腺、脾脏和淋巴结γ δ T细胞的异质性图谱特征。该研究是由暨南大学医学部生物医学转化研究院/珠海市人民医院尹芝南教授课题组(李振华博士后、杨全利博士后和唐欣博士后为论文第一作者,尹芝南教授和曹广超副研究员为论文共同通讯作者)在Science Bulletin上在线发表的题为“Single-cell RNA-seq and chromatin accessibility profiling decipher the heterogeneity of mouse γ δ T cells”的研究论文,
欧易生物资深技术支持巴永兵
为本篇文章的署名作者。
基本信息
题目:Single-cell RNA-seq and chromatin accessibility profiling decipher the heterogeneity of mouse γ δ T cells
期刊:Science Bulletin
影响因子:
11.78
发表时间:2021.11.16
材料:小鼠胸腺、脾脏和淋巴结 γ δ T细胞
技术:
欧易生物
10×Genomics scRNA-seq+scATAC-seq、单细胞转录组测序
文章摘要
γ δ T细胞具有重要的免疫监视功能,其不同亚型在维持组织稳态和局部免疫反应中发挥不同作用,但是γ δ T细胞的异质性尚未完全解析。本文作者对小鼠胸腺、脾脏和淋巴结中的γ δ T细胞开展了单细胞转录和染色质开放性组学分析,系统性解析了其异质性。作者发现经典的γ δ T1(IFN-γ+)和T17(IL-17A+)亚群内部也存在显著的异质性并推断了其潜在调控机制。通过对胸腺γ δ T细胞进行拟时序分析,作者构建了其发育轨迹。有意思的是,作者发现胸腺中存在一群独立于T1和T17的新亚群GZMA+ γ δ T细胞,并且发现该亚群具有前体细胞特征。作者还通过SCENIC分析、转录因子识别基序富集发现了一个新的γ δ T17转录抑制因子NR1D1,并利用基因敲除小鼠进行了验证。综上,本文构建了小鼠γ δ T单细胞转录图谱和单细胞染色质开放性图谱,为深入解析γ δ T细胞异质性和亚群调控机制提供了宝贵的资源库。

具体研究内容解析
1. 基于scRNA-seq探究组织特异性的γ δ T细胞表达图谱
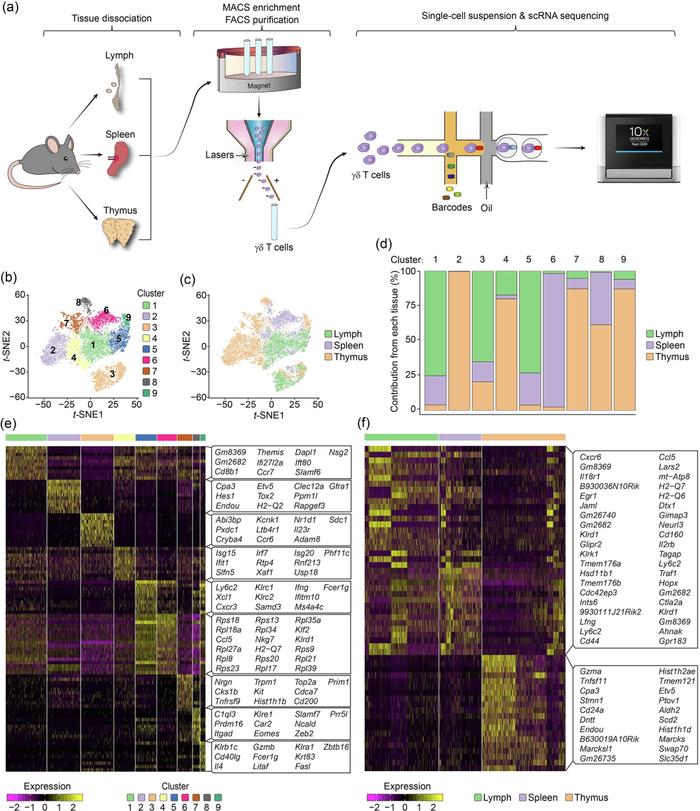
Figure 1. 基于scRNA-seq分析γ δ T图谱特征
Fig. 1a展示了该篇文章的取样方案,作者基于MACS和FACS分选出小鼠胸腺、脾脏和淋巴结γ δ T细胞进行单细胞转录组测序,三个样本分别捕获了5394、2702和4818个细胞。tSNE降维聚类发现,一些亚群在每个组织中均有广泛分布,而有些亚群则展现出组织特异性特征,如C2主要存在于胸腺中,C6主要存在于脾脏中(Fig. 1c, d)。Fig. 1e展现了每个亚群的top marker gene。作者基于亚群特异性marker gene的表达、免疫相关基因表达模式和GSVA分析等进一步阐述了γ δ T亚群的功能特征。值得注意的是,作者发现淋巴结和脾脏的γ δ T基因表达程序高度相似,而来自胸腺的γ δ T细胞与淋巴和脾脏的基因表达模式部分相似,提示γ δ T从胸腺向外周免疫器官的趋化迁移的特征(Fig. 1f)。
2. γ δ T1和γ δ T17细胞的异质性特征

Figure 2. γ δ T1和γ δ T17细胞的异质性特征
根据产生细胞因子过程的不同,γ δ T主要可以分为γ δ T1(IFN-γ+)和T17(IL-17A+)两种亚型。单细胞转录组测序结果发现,Il17a主要表达于C3群,C5、C8和C9三个亚群主要表达IFN-γ(Fig. 2a, b)。基于差异基因热图和代谢功能分析发现(Fig. 2c), γ δ T1细胞高表达趋化因子、细胞毒性和脂代谢相关基因,γ δ T17高表达炎症反应、胸腺细胞迁移和糖酵解相关基因,表明γ δ T1和γ δ T17的功能异质性。为了进一步探究两者功能的差异,作者对γ δ T1和γ δ T17进行SCENIC分析,结果发现如调控IFN-γ表达的调控子Stat1在γ δ T1中高富集,调控IL-17A表达的Maf/Rorc在γ δ T1中高表达,与预期相符。此外,作者发现了一些潜在可能区分调控γ δ T1和γ δ T17的转录因子,例如与γ δ T1相比,Rora在γ δ T17中调控活性明显较高(Fig. 2d)。
为了进一步阐明γ δ T1和γ δ T17的异质性特征,作者对这两个亚型分别进行了降维聚类分析。对于γ δ T17,作者将γ δ T17分了5个亚群,并根据亚群特征性基因的表达,对每个亚群进行了功能注释。值得注意的是,胸腺中γ δ T17展现出明显的异质性特征(包括Sell high / Cd44 low群,Scart2 high / Il17f high群和Scart1 high / Trdv4 high群),尤其是Scart2 high / Il17f high群和Scart1 high / Trdv4 high群展现出胸腺组织特异性且分别高表达淋巴细胞分化和ER局部蛋白复合物功能相关基因(Fig. 2f-2h),表明这两个群体可能迁移到淋巴组织中,并继续分化成具有特定转录特征的新亚群。同样地,作者对γ δ T1进行类似分析(Fig. 2i-2k)。
3. 基于单细胞转录组测序重塑胸腺γ δ T细胞发育轨迹
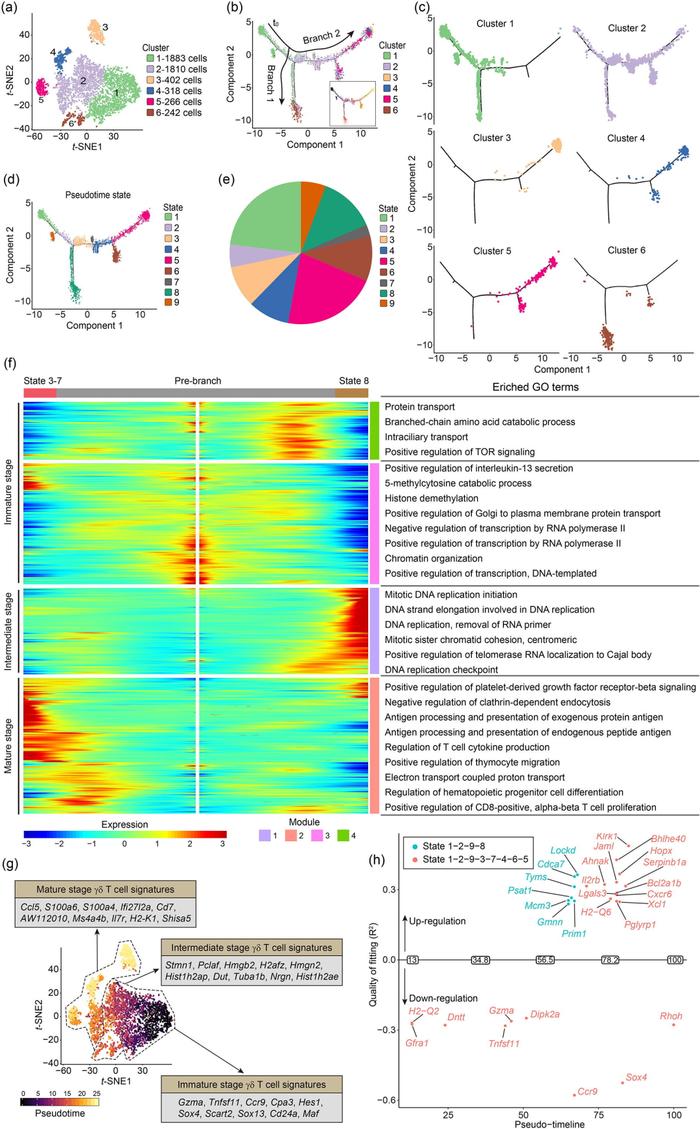
Figure 3. 基于拟时序分析重塑γ δ T细胞发育轨迹
为进一步探究胸腺中γ δ T细胞的发育特征,作者基于monocle2对胸腺γ δ T细胞进行拟时序分析(Fig. 3b-3e)。结果发现cluster和拟时序产生的state可以很好的对应在一起,并进一步构建了胸腺γ δ T细胞基因变化热图和功能变化特征(Fig. 3f)。依据于拟时序时间顺序关系,作者将胸腺T细胞分为三个发育阶段:未成熟期(对应Fig. 3f热图module3和module4功能特征)、过渡期(对应module1功能特征)和成熟期(对应module2功能特征)。该发育轨迹的构建,有助于深入了解γ δ T细胞的发育过程和潜在的调控基础。
4. 发现胸腺中独特的功能亚群Gzma+ γ δ T cells
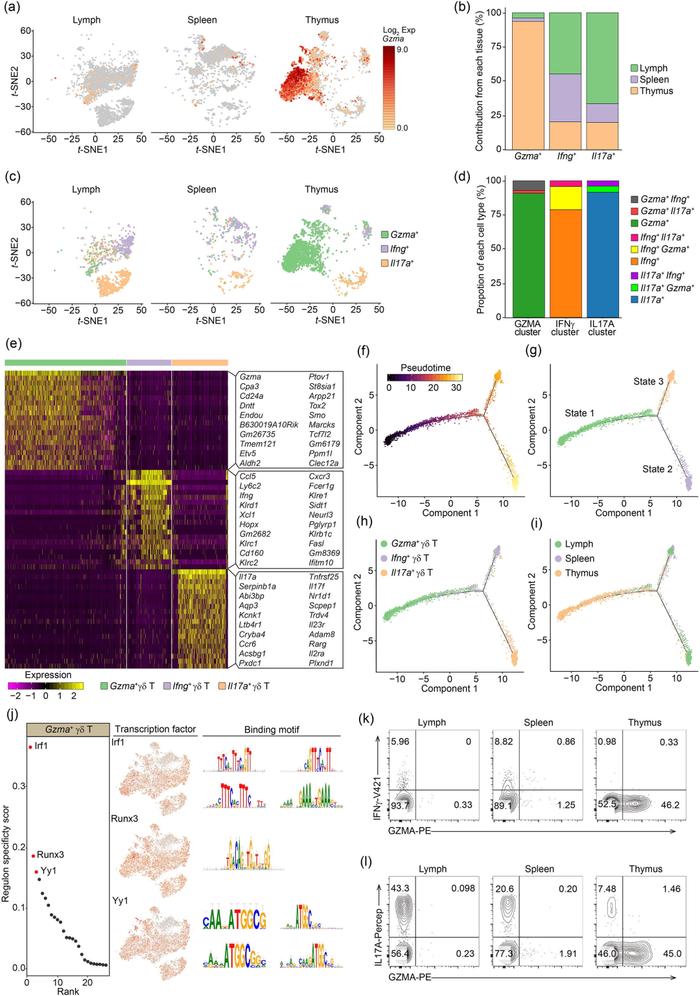
Figure 4. 胸腺中独特的功能亚群Gzma+ γδ 细胞
作者发现,约85%的胸腺γ δ T为Gzma表达阳性,而淋巴结和脾脏中γ δ T细胞Gzma阳性的比例很低(Fig. 4a-4d),表明Gzma+ γ δ T cells可能是特定存在于胸腺中的亚群。接下来,作者想要解析Gzma+ γ δ T细胞和Ifng+ γ δ T细胞和Il17a+ γ δ T细胞三者的关系。基于SCENIC分析(Fig. 4j)和体外细胞因子染色结果(Fig. 4k-4l),染色结果发现GZMA确实主要表达于胸腺γ δ T中,而在淋巴结和脾脏中表达量较低,SCENIC结果则暗示Gzma+ γ δ T细胞主要表现非成熟阶段的发育特征。以上结果表明,Gzma+ γ δ T细胞可能是先于Ifng+ γ δ T细胞和Il17a+ γ δ T细胞存在的一类早期γ δ T细胞。
5. 基于单细胞ATAC测序探究组织特异性的γ δ T细胞染色质可及性图谱
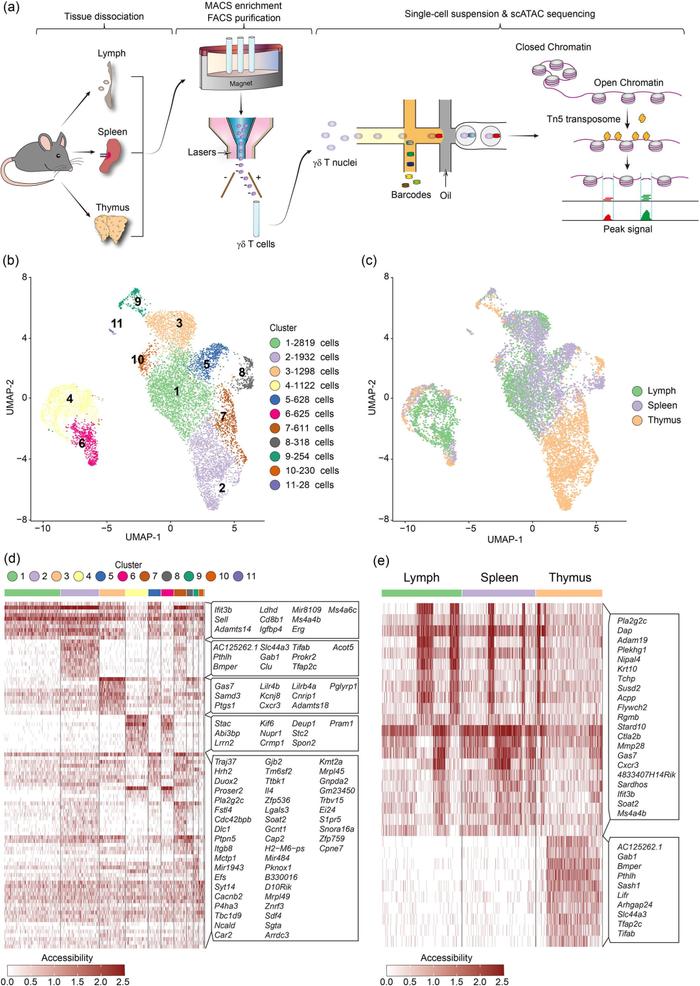
Figure 5. 基于单细胞ATAC测序分析γ δ T图谱特征
由于高通量单细胞转录组在检测低丰度基因包括转录因子上的不足,而开放区染色质可及性可能在基因转录之前就已经完成,因此ATAC测序对未来基因的转录活性具有预测价值。因此,这里作者同时对胸腺、脾脏和淋巴结的γ δ T细胞进行了单细胞ATAC测序。Fig. 5a和Fig. 5b-5e分别展示实验流程和基于ATAC数据的降维聚类结果。结果同单细胞转录组类似,淋巴结和脾脏γ δ T细胞展现出了类似的染色质开放性结果,而胸腺展现出了部分相似的特征,表明胸腺作为γ δ T细胞的主要发育器官,与周围其他器官γ δ T细胞表达特征明显不同。
6. 基于scATAC-seq测序重塑胸腺γ δ T细胞发育谱系

Figure 6.基于scATAC-seq测序重塑胸腺γ δ T细胞发育谱系
在scRNA-seq部分,作者基于monocle2构建了胸腺γ δ T细胞的发育轨迹,在scATAC-seq部分作者同样利用ArchR重塑了胸腺γ δ T细胞的发育轨迹(Fig. 6a-6b)。Fig. 6c和Fig. 6d通过热图分别展示出随着发育轨迹基因活性和motif富集TF的变化轨迹。与scRNA-seq的结果一致,在胸腺γ δ T细胞发育早期,Gzma基因位点随着TCF3-motif的富集而活跃。在T和B细胞发育过程中,TCF3通过顺式调节模块的结合位点调控Rag的表达,并激活多种增强子。作者推测,TCF3可能是促进γ δ T细胞发育和/或分化的重要表观遗传调节因子。
7. scRNA-seq和scATAC-seq整合分析以及NR1D1敲除验证
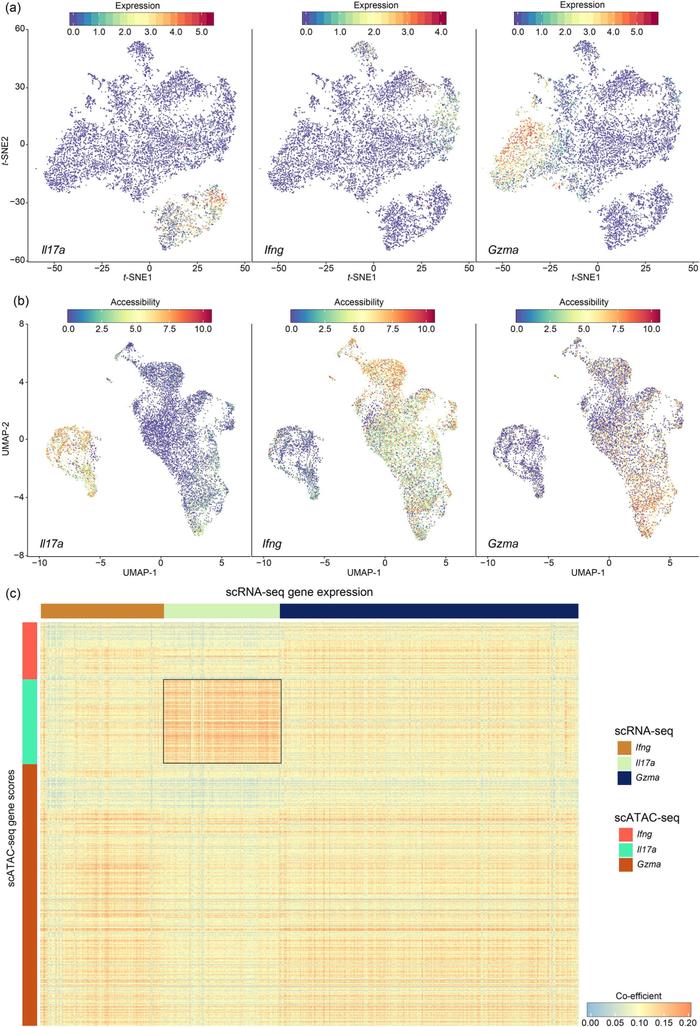
Figure 7.scRNA-seq和scATAC-seq整合分析
整合分析发现,无论是scRNA-seq还是scATAC-seq结果,Il17a+、Ifng+和Gzma+ γ δ T三个亚群之间降维聚类分布很少有重叠部分(Fig. 7a-7b),表明这三个亚群之间功能上存在很大的不同。scRNA-seq和scATAC-seq数据的相关性分析发现,Il17a+ γ δ T细胞亚群具有独特的特性,在转录和表观遗传基础上显示出更好的匹配程度(Fig. 7c),提示Il17a+ γ δ T细胞亚群的高度异质性早在关键基因转录调控之前的染色质状态就已确定。接下来,作者试图寻找调控Il17a+ γ δ T分化和发育的关键转录因子,基于scRNA-seq的SCENIC结果筛选以及scATAC-seq中motif TF富集(Fig. 8a-8b),作者将目标放在了可能调控Il17a+ γ δ T发育的潜在转录因子NR1D1。接下来,作者利用NR1D1基因敲除小鼠进行了验证,结果发现敲除前后γ δ T细胞的比例并未发生变化(Fig. 8c),表明NR1D1在γ δ T的分化和发育中并不是必需的。值得注意的是,相对于正常组,敲除组小鼠产生了更高比例的IL-17A,表明NR1D1可以特异性的抑制γ δ T17细胞的分化。
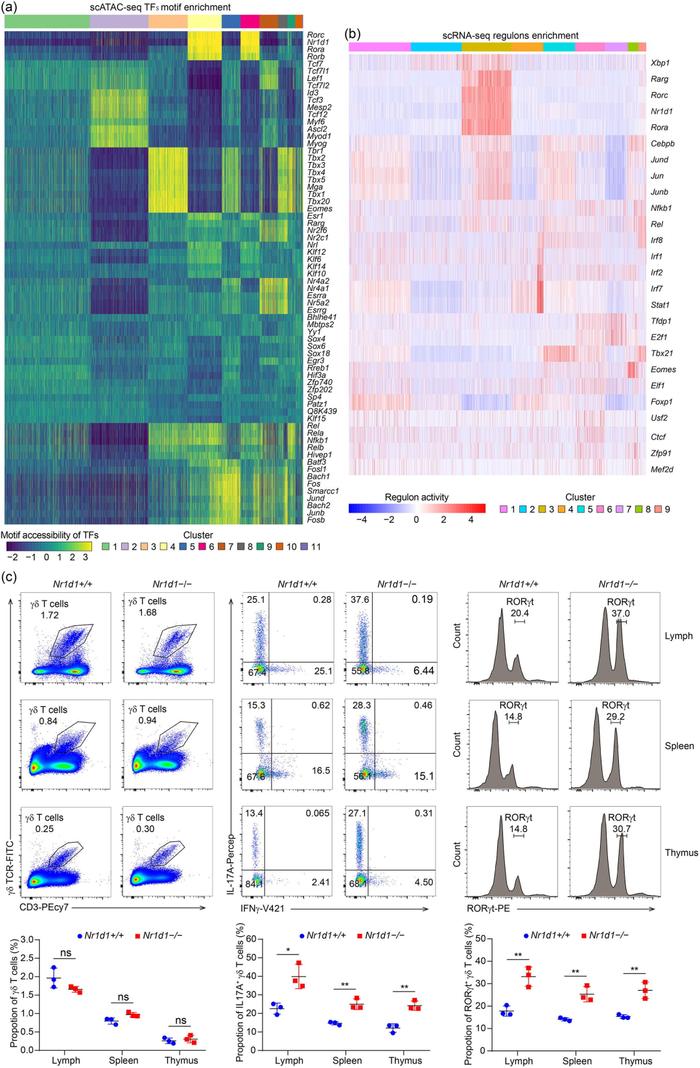
Figure 8.NR1D1敲除验证
欢迎百度搜索欧易生物——访问欧易生物官网——了解单细胞转录组技术
猜你还想看
1. 项目文章 | 欧易单细胞测序助力解析新辅助化疗手段——紫杉醇+顺铂与单纯手术治疗在食管鳞状细胞癌中的肿瘤微环境差异
2. 项目文章 | Diabetes!欧易单细胞测序揭示2型糖尿病小鼠视网膜细胞的新转录图谱和异质性
3. 项目文章 | 单细胞转录组显示高级别浆液性卵巢癌的异质性
4. 项目文章 | 单细胞转录组测序分析子宫腺肌症患者在位内膜和异位病灶的转录特征
欢迎转发到朋友圈
转载请注明文本转自欧易生物
发布于:上海








