精准狙击“衰老12大标识”!地中海、生酮……最佳抗衰食谱是哪个


“ 民以食为天 ”,饮食是日常生活中最重要,也是最易被忽略的大事。
无论是号称“全球最健康饮食”的 地中海 饮食,还是以“吃肉喝油就能瘦”的惊人口号成功引起大家注意的 生酮 饮食,都随着永不停歇的社交媒体不断涌入国内大众的视野,悄悄改变着人们的餐桌。

足球明星大卫·贝克汉姆的妻子 维多利亚·贝克汉姆 出生于1974年,右图是2022年英国版《Vogue》杂志的一则报道中拍摄的随刊照片。
虽说杂志照片会添加些“必要的修饰”,但依然不难看出其身材挺拔、气场强大、容光焕发、“不像48岁生过4个孩子的女人该有的样子”。
大卫·贝克汉姆爆料称:“自从遇见维多利亚以来,她的盘子里只有 烤鱼和蒸菜 。”维多利亚自己也说,她几乎不吃油、盐、酱汁,唯一吃过的“垃圾食品”是上面撒了盐的全麦吐司。
虽然维多利亚的饮食有种富豪惯有的 变态的矫情 (习惯了),但她永葆青春的秘密也许就在饮食之中!
近日,法国图卢兹大学医院老年病学与老龄化研究所所长Philipe de Souto Barreto团队发表于国际期刊Ageing Research Reviews的综述,从代表了生物体衰老程度的“衰老标识”出发, 系统总结了全球各地流行的健康饮食策略延缓衰老的底层原理 ,把这些欧美有钱人奉为圭臬的健康食谱扒了个底儿掉 [1]。

不瞒你说,小编读完这篇综述觉得,维多利亚的饮食方式虽然有缺陷,但还是有点东西的! 好饮食决定女人一生 啊。
PART 1 衰老标识是啥?看完年轻20岁!
衰老是一种复杂的生物学现象,是大多数慢性病和绝症的主要危险因素。我们每个人都在时间这把“杀猪刀”的追赶下,在衰老的路上头也不回地狂奔。 向死而生 ,似乎是一件命中注定的事实,也是无人敢挑战的真理。
但是,有这么一群科学家认为: 衰老是可逆的 。他们将驱动衰老和衰老相关疾病的基本原理整合在一起,形成了老年科学学科(Geroscience)[1]。
2013年,他们从分子、细胞和系统的角度出发,提出了“ 衰老的九大标识 ”——基因组不稳定、端粒磨损、表观遗传改变、蛋白质稳态失衡、营养感应失调、线粒体功能障碍、细胞衰老、干细胞耗竭、细胞间通讯改变[11]。
2023年,衰老标识更新为12种,加入了 巨自噬失活、慢性炎症和肠道微生物失调 [12]。
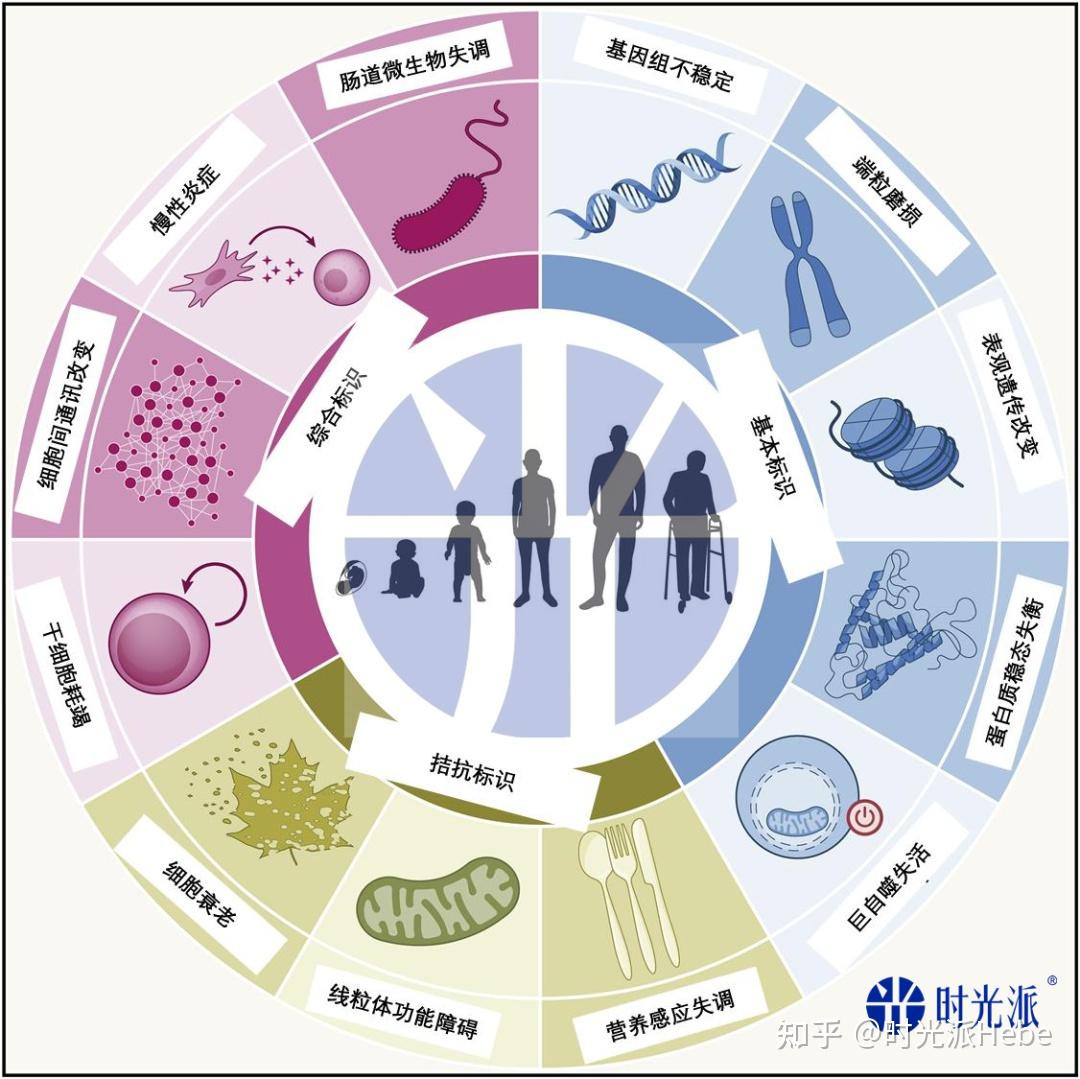
其中,巨自噬失活是蛋白质稳态失衡的一部分,慢性炎症和肠道微生物失调是细胞间通讯改变的组成部分,因它们各有超越原衰老标识的特点,故将这3种标识独立出来,与原“衰老九大标识”并列讨论,形成“ 衰老十二大标识 ”[1]。
PART 2 “好好吃饭”得长生!健康饮食与衰老九大标识
在文章开头介绍的饮食策略与衰老标识综述中,作者从经典的“衰老九大标识”出发,结合PubMed数据库中的大量实验室研究和临床试验结果,为我们分析能够 减轻甚至逆转衰老标识的饮食策略 。
1.基因组不稳定
随着衰老,我们的遗传物质——DNA在不断受到氧化损伤,与之而来的是基因组愈发不稳定。
研究表明,实行 25%-55%热量限制 [1]以及 宗教斋戒禁食法 (一周2天,从日出到日落期间不进食)[2],与DNA损伤的减少有关。

另外, 地中海饮食 也与DNA氧化损伤标志物——8-Oxo-2'-脱氧鸟苷(8-oxodG)的减少有关。
一项临床试验中,绝经后代谢综合征妇女实施一年的地中海饮食,并添加额外的橄榄油(1升/周)或额外的坚果(15、7.5克/天的核桃、杏仁和榛子),观察到尿液中8-oxodG较对照组显著减少[3]。
地中海饮食是一种采用大量 橄榄油 、豆类、天然全谷类、蔬果和适量鱼类、乳制品,减少红肉与加工食品摄取的饮食方案。其主要成分橄榄油具有抗氧化、抗炎功效[4]。
2.端粒磨损
一项以韩国成年人与老年人为观察对象、随访10年的队列分析显示,一种谨慎饮食模式:增加豆类、坚果、海藻、水果、乳制品和咖啡的摄入量,减少红肉或加工肉类以及加糖碳酸饮料的摄入量,与更长的 白细胞端粒长度 有关[5]。(与地中海饮食方案有大量重叠,但多了咖啡,不愧是血液中流淌着冰美式的民族)
另外,一项长达5年的地中海饮食干预试验观察到,地中海饮食使50岁以上成年人端粒变长,并且此结果的产生与热量限制无关,却与遗传有关:端粒的延长只在那些携带过氧化物酶体增殖物激活受体γ2基因(PPARγ2)的Ala等位基因人群中出现[6]。
PPARγ是一种转录因子 ,在脂肪细胞分化和脂肪细胞特异性基因的表达中起着关键作用。1998年发表于Nature子刊的研究表明,PPARγ2 Ala基因型与体重指数降低和胰岛素敏感性提高有关[7]。
3.表观遗传改变
表观遗传改变是指随着年龄增长,遗传物质DNA表面的一些化学修饰发生了变化,其中最典型的是DNA甲基化水平的变化。

科学家发现30%热量限制、 33%蛋白质限制 (不限制热量,而是将蛋白质摄入比例从正常的21%降低到7%[8])、0.12%蛋氨酸限制均逆转了临床前模型——鼠的衰老相关DNA甲基化水平改变[1]。
在这部分里,作者也大力推荐了橄榄油:
2015年,一项以鼠为模型的实验中观察到:喂食富含橄榄油的饲料使乳腺和肿瘤的全局DNA甲基化水平都更高了,阻碍了肿瘤的发生和进展[9]。

4.蛋白质稳态失衡
蛋白质稳态指的是:细胞内的自噬、蛋白酶体系统调节蛋白质合成与折叠过程[10],使蛋白质处于正常行使功能的稳定状态。
衰老伴随的蛋白质稳态丧失会导致破坏性蛋白成分的积累,进而导致细胞衰老和年龄相关疾病,如神经退行性疾病(阿尔茨海默病和帕金森病)和代谢紊乱[10-12]。
30-40%热量限制和间歇性禁食 是目前证据最丰富的调节蛋白质稳态饮食干预手段[1]。
另外,限制蛋白质的摄入能够激活肌肉中的泛素-蛋白酶体系统,维持蛋白质稳态;地中海饮食或生酮饮食能够上调自噬,这两类饮食策略也具有潜在健康益处[1]。

5.营养感应失调
营养感应失调是经典的衰老调节途径。我们体内的营养感应机制主要分为两类:
1. 合成代谢途径 :包括胰岛素和胰岛素样生长因子-1(IIS途径)以及mTOR复合物(mTORC),它们感知体内葡萄糖和氨基酸水平的升高,启动机体合成蛋白质与脂肪,将能量储存在机体内;
2. 分解代谢途径 :包括AMPK和Sirtuins,它们分别监测高水平的AMP和NAD+来感知营养缺乏,启动分解代谢消耗机体内储存的能量[1]。
伴随衰老,机体合成代谢水平升高而分解代谢水平下降。因此,IIS和mTOR通路的下调以及AMPK和SIRT1的上调都与长寿有关。
研究表明,25-40%热量限制和禁食下调mTORC1或上调AMPK和SIRT1,延长不同物种的寿命;对mTORC1的影响也可以通过蛋白质限制或支链氨基酸(BCAA)限制来实现[1]。

6.线粒体功能障碍
线粒体功能随着年龄增长而下降,其内部的关键能量代谢反应—— 氧化呼吸链 效率也随之下降,导致ATP生成减少和活性氧(ROS)生成增加[13]。
40%热量限制能够提升线粒体功能、形态和促进线粒体生物发生;生酮饮食同样促进线粒体生物发生和提升其抗氧化能力[1]。
7.细胞衰老
衰老细胞的积累是DNA损伤、端粒磨损、氧化应激、全身慢性炎症等因素的综合结果[9,14], 热量限制或长期坚持富含坚果的地中海饮食 能减缓此过程[1]。
30-40%的热量限制可降低人体组织中的一系列衰老标志物——衰老相关分泌表型(SASP)的水平[1]。

8.干细胞耗竭
当机体发生损伤时,干细胞和祖细胞会被促炎细胞因子等“警报信号”吸引至损伤处,开启损伤修复机制。然而,随着时间的流逝,复制再生次数增多,干细胞也会衰老、死亡[15]。
干细胞耗竭损伤了机体的自我修复能力,使衰老人群更容易罹患多种疾病。
研究表明, 热量限制和添加坚果的饮食模式 与提升骨骼肌和肠道干细胞功能相关,有潜在的延缓干细胞耗竭效果[1,16]。
9.细胞间通讯改变
衰老导致机体内调节内环境稳态的神经内分泌系统失调,细胞间传递信号的细胞因子中充斥着IL-6、TNF-α和IL-1β等致炎因子,导致慢性炎症和肠道菌群失调[11]。
饮食限制可以通过抑制NF-kB 信号和减少上述致炎细胞因子的释放来改善慢性炎症状态。生酮饮食在啮齿动物实验中被证明可通过抑制NLRP3 炎性体诱导的 IL-1β 改善大脑炎症。
以人类为受试对象的临床试验表明,以 植物性食物、鱼类和低脂乳制品 为主的饮食模式可使炎症标志物浓度降低[1]。

时光派点评
阅读完这篇综述,派派发现 热量限制(CR) 和 富含橄榄油的地中海饮食 几乎能够减轻所有的衰老标识。
以蔬菜水果等植物作为基底,以鱼类作为主要蛋白质来源,并添加核桃等坚果,使用橄榄油烹饪,并且最重要的是——少吃点,就是一顿完美的抗衰健康餐啦。
像维多利亚·贝克汉姆一样,以无油烤鱼和蒸菜为主的饮食方式,小编认为其中的道理大部分在于它的 难吃 起到的一些热量限制作用,以及增加鱼类和蔬菜的膳食比例、限制加工食品(面包等甜点)的摄入也是正确的饮食方式。当然,还是推荐她加一些橄榄油佐餐,更健康、更美味~
读完这篇文章,不知屏幕前的你有没有注意到,在西方科研体系下,饮食研究全部基于欧美国家、地中海地区,甚至东南亚的饮食习惯,而盛产美食的 中国 却很少被提及。
嗨,这帮老外,一辈子没吃过糖醋排骨、重庆小面、北京烤鸭,是他们没有福气!我们虽然摄入了高糖高脂和糖基化终产物,可是我们获得了快乐呀~不说了,来顿重庆火锅, 蘸料换成橄榄油!
参考文献:
[1] Grande de França, N. A., Rolland, Y., Guyonnet, S., & de Souto Barreto, P. (2023). The role of dietary strategies in the modulation of hallmarks of aging. Ageing research reviews, 87, 101908. doi: 10.1016/j.arr.2023.101908
[2] Teng, N. I., Shahar, S., Rajab, N. F., Manaf, Z. A., Johari, M. H., & Ngah, W. Z. (2013). Improvement of metabolic parameters in healthy older adult men following a fasting calorie restriction intervention. The aging male : the official journal of the International Society for the Study of the Aging Male, 16(4), 177–183. doi: 10.3109/13685538.2013.832191
[3] Mitjavila, M. T., Fandos, M., Salas-Salvadó, J., Covas, M. I., Borrego, S., Estruch, R., Lamuela-Raventós, R., Corella, D., Martínez-Gonzalez, M. Á., Sánchez, J. M., Bulló, M., Fitó, M., Tormos, C., Cerdá, C., Casillas, R., Moreno, J. J., Iradi, A., Zaragoza, C., Chaves, J., & Sáez, G. T. (2013). The Mediterranean diet improves the systemic lipid and DNA oxidative damage in metabolic syndrome individuals. A randomized, controlled, trial. Clinical nutrition (Edinburgh, Scotland), 32(2), 172–178. doi: 10.1016/j.clnu.2012.08.002
[4] Larsson, S. (2022). Can Small Amounts of Olive Oil Keep the Death Away?. Journal Of The American College Of Cardiology, 79(2), 113-115. doi: 10.1016/j.jacc.2021.11.006
[5] Lee, J. Y., Jun, N. R., Yoon, D., Shin, C., & Baik, I. (2015). Association between dietary patterns in the remote past and telomere length. European journal of clinical nutrition, 69(9), 1048–1052. doi: 10.1038/ejcn.2015.58
[6] Fernández de la Puente, M., Hernández-Alonso, P., Canudas, S., Marti, A., Fitó, M., Razquin, C., & Salas-Salvadó, J. (2021). Modulation of Telomere Length by Mediterranean Diet, Caloric Restriction, and Exercise: Results from PREDIMED-Plus Study. Antioxidants (Basel, Switzerland), 10(10), 1596. doi: 10.3390/antiox10101596
[7] Deeb, S., Fajas, L., Nemoto, M., Pihlajamäki, J., Mykkänen, L., & Kuusisto, J. et al. (1998). A Pro12Ala substitution in PPARγ2 associated with decreased receptor activity, lower body mass index and improved insulin sensitivity. Nature Genetics, 20(3), 284-287. doi: 10.1038/3099
[8] Fontana, L., Adelaiye, R. M., Rastelli, A. L., Miles, K. M., Ciamporcero, E., Longo, V. D., Nguyen, H., Vessella, R., & Pili, R. (2013). Dietary protein restriction inhibits tumor growth in human xenograft models. Oncotarget, 4(12), 2451–2461. doi: 10.18632/oncotarget.1586
[9] Rodríguez-Miguel, C., Moral, R., Escrich, R., Vela, E., Solanas, M., & Escrich, E. (2015). The Role of Dietary Extra Virgin Olive Oil and Corn Oil on the Alteration of Epigenetic Patterns in the Rat DMBA-Induced Breast Cancer Model. PloS one, 10(9), e0138980. doi: 10.1371/journal.pone.0138980
[10] Koga, H., Kaushik, S., & Cuervo, A. M. (2011). Protein homeostasis and aging: The importance of exquisite quality control. Ageing research reviews, 10(2), 205–215. doi: 10.1016/j.arr.2010.02.001
[11] López-Otín, C., Blasco, M. A., Partridge, L., Serrano, M., & Kroemer, G. (2013). The hallmarks of aging. Cell, 153(6), 1194–1217. doi: 10.1016/j.cell.2013.05.039
[12] López-Otín, C., Blasco, M. A., Partridge, L., Serrano, M., & Kroemer, G. (2023). Hallmarks of aging: An expanding universe. Cell, 186(2), 243–278. doi: 10.1016/j.cell.2022.11.001
[13] Bratic, A., & Larsson, N. G. (2013). The role of mitochondria in aging. The Journal of clinical investigation, 123(3), 951–957. doi: 10.1172/JCI64125
[14] Calcinotto, A., Kohli, J., Zagato, E., Pellegrini, L., Demaria, M., & Alimonti, A. (2019). Cellular Senescence: Aging, Cancer, and Injury. Physiological reviews, 99(2), 1047–1078. doi: 10.1152/physrev.00020.2018
[15] Mansilla, E., Díaz Aquino, V., Zambón, D., Marin, G. H., Mártire, K., Roque, G., Ichim, T., Riordan, N. H., Patel, A., Sturla, F., Larsen, G., Spretz, R., Núñez, L., Soratti, C., Ibar, R., van Leeuwen, M., Tau, J. M., Drago, H., & Maceira, A. (2011). Could metabolic syndrome, lipodystrophy, and aging be mesenchymal stem cell exhaustion syndromes?. Stem cells international, 2011, 943216. doi: 10.4061/2011/943216
[16] Guan, F., Tabrizian, T., Novaj, A., Nakanishi, M., Rosenberg, D. W., & Huffman, D. M. (2018). Dietary Walnuts Protect Against Obesity-Driven Intestinal Stem Cell Decline and Tumorigenesis. Frontiers in nutrition, 5, 37. doi: 10.3389/fnut.2018.00037

