单细胞测序正流行!这篇Nature Medicine顶级单细胞文献全套复现,你值得拥有!
单细胞测序技术 的产生对于生命科学研究无疑是个里程碑式的突破,不同于传统测序,单细胞测序是基于单个细胞的测序技术,而细胞是生命体发挥功能的最小单位,得益于单细胞极高的分辨率,研究者们可以精确识别每个细胞或细胞群所具有的特征,能够揭示单个细胞的基因结构和基因表达状态,反映细胞间的异质性。
单细胞测序的应用领域相当广泛,肿瘤、发育生物学、微生物学、神经科学等等。它也是高分文章的常客,Cell、Nature、Science上不同研究方向的单细胞测序文章比比皆是。 可以说,了解了单细胞测序就了解了生命科学领域的最前沿发现。
今天就为大家解读Nature Medicine杂志上的一篇经典的单细胞高分文献,我们从文献入手,带领大家了解单细胞的应用方向。

内容很长,一定要看到最后!
Phenotype molding of stromal cells in the lung tumor microenvironment(肺癌肿瘤免疫微环境中基质细胞的表型特征)
背景知识
肿瘤具有广泛的异质性,但目前的大部分异质性研究主要限于癌细胞。这些研究揭示了一个非常复杂和多样化的肿瘤细胞图谱,并表明肿瘤细胞具有高度的基因多样化和克隆选择。然而,越来越多的研究表明,与肿瘤相关的基质细胞,如巨噬细胞、T细胞和成纤维细胞,以及它们为形成肿瘤微环境而建立的复杂的细胞生态系统,本身可能与肿瘤细胞一样复杂和异质。这种异质性的程度,它如何被肿瘤中的其他细胞塑造,反之也如何直接影响它们,仍然没有得到很好的描述。本文揭示了肺癌微环境的构成,从基质细胞亚群、信号通路、关键分子以及患者生存分析等多个层面开展研究。
文章简化流程

图标解读
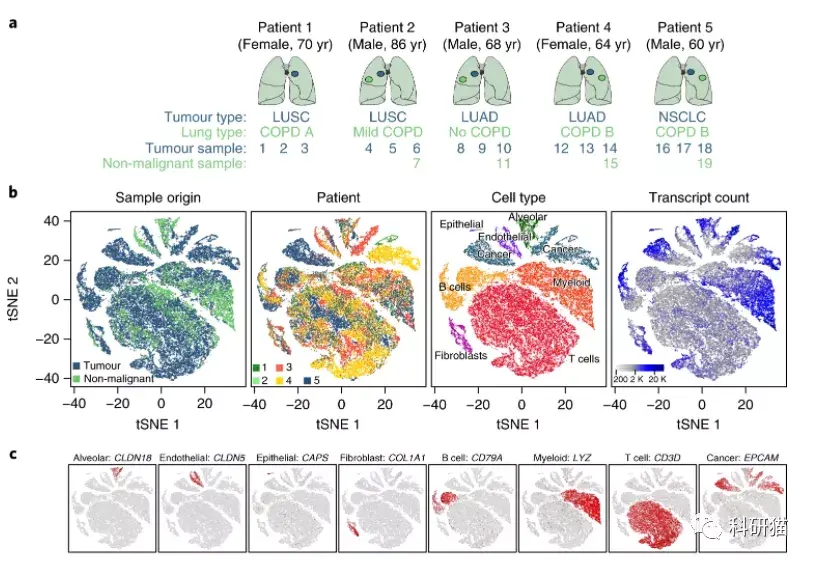
a,样本来源
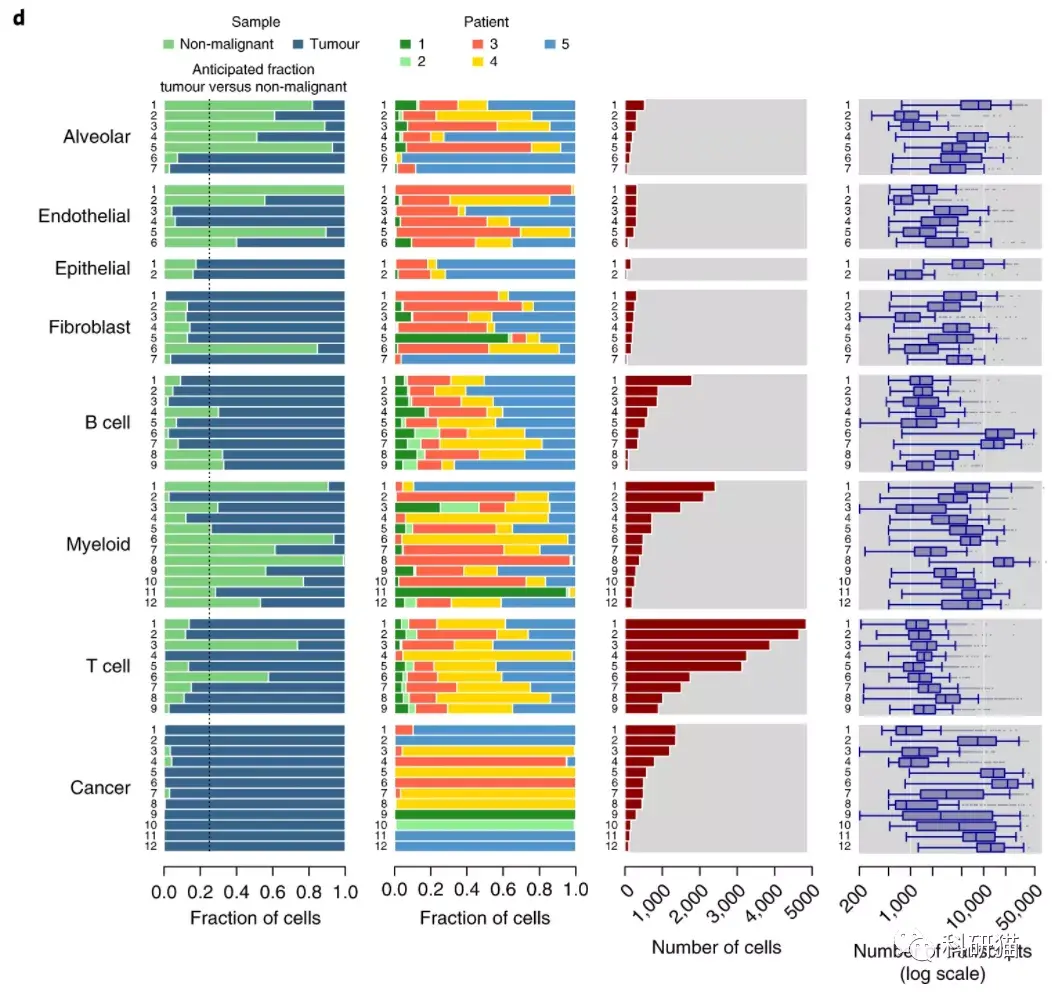
b,52,698个细胞的tSNE,每个细胞用颜色编码(从左到右依次):样本来源类型(肿瘤或非恶性组织);相应的病人;相关的细胞类型和在该细胞中检测到的转录本(UMI)的数量
c,不同种类细胞的marker。
d,(从左到右):来源于4个非恶性样本和15个肿瘤样本的细胞比例;来源于5个病人中每个人的细胞比例;细胞数量和转录本数量的箱形图
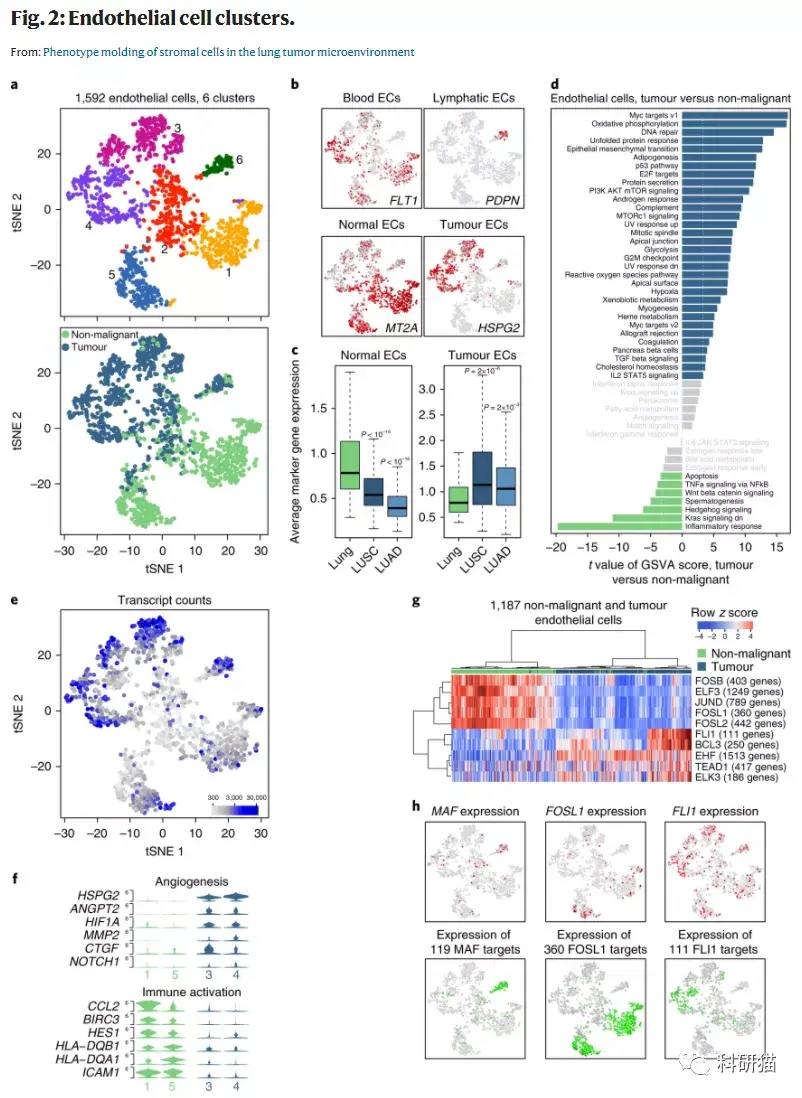
a, 1,592个 内皮细胞 的tSNE图,按其相关的亚群(上)或来源的样品类型(下)进行颜色注释。
b, tSNE图按血液、淋巴、肿瘤和正常内皮细胞的标记基因的表达量进行着色。
c, 正常内皮细胞的29个标记基因或肿瘤内皮细胞的7个标记基因在来自正常肺(n = 108)、LUSC(n = 501)或LUAD(n = 513)的TCGA样本中平均表达。
d, 肿瘤和正常内皮细胞(n = 618和569个细胞,分别来自5名患者)之间通过GSVA对每个细胞的通路进行的差异分析。
e,内皮细胞的tSNE图,根据每个细胞中检测到的转录本的数量进行颜色注释。
f, 小提琴图显示参与血管生成和免疫激活的特定基因的表达,按正常或肿瘤内皮细胞亚群分类。
g, 使用SCENIC计算的转录因子表达调节的曲线下面积(AUC)得分的热图
h, 内皮细胞的tSNE图,用颜色注释(上图)MAF、FOSL1和TEAD1的表达(从左到右),以及(下图)这些转录因子的调节活性的AUC,对应于其靶基因的表达调节程度。
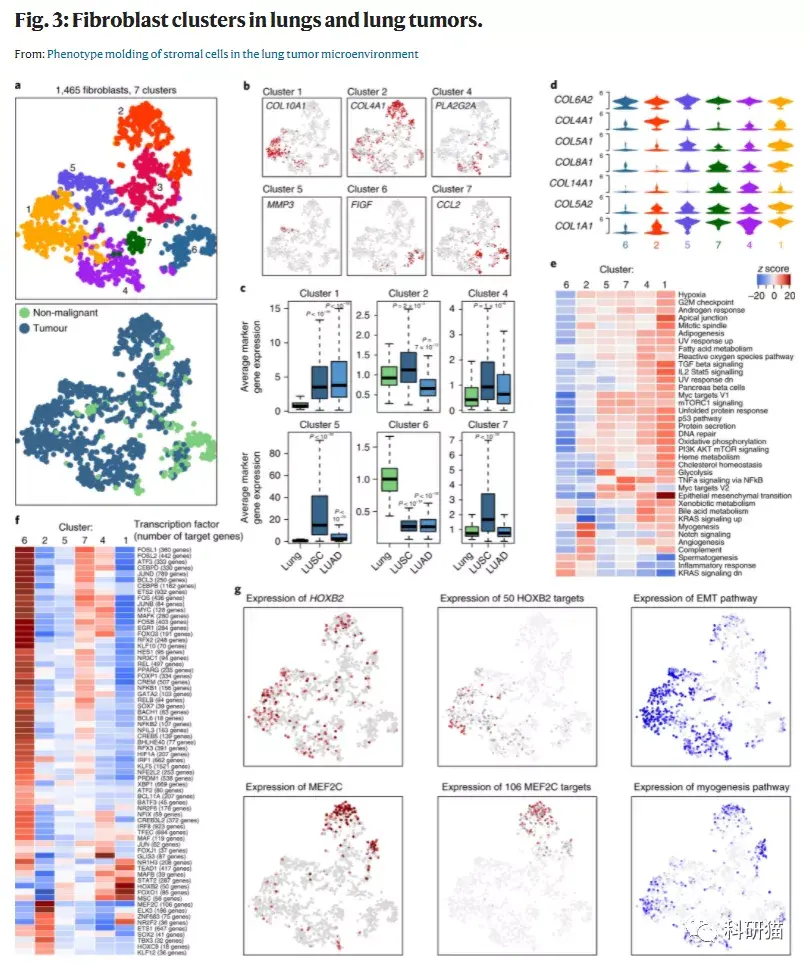
a, 1,465个 成纤维细胞 的tSNE图,按其相关的亚群(上)或来源的样品类型(下)进行颜色注释。
b, tSNE图,按亚群的marker基因的表达(灰色到红色)进行着色。
c, 每个亚群的成纤维细胞的marker基因在来自正常肺(n = 108)、LUSC(n = 501)或LUAD(n = 513)的TCGA样本中平均表达。
d, 小提琴图显示成纤维细胞亚群中编码胶原蛋白的特定基因的表达。
e, 通过GSVA对不同成纤维细胞亚群的通路的差异分析。
f, 每个成纤维细胞亚群之间用SCENIC预测的转录因子表达调节的AUC分数的t值热图。
g,成纤维细胞的tSNE图,用颜色注释(左)HOXB2和MEF2C的表达,这些转录因子的预测调节活性的AUC(中)和相关通路的GSVA分数(右)。
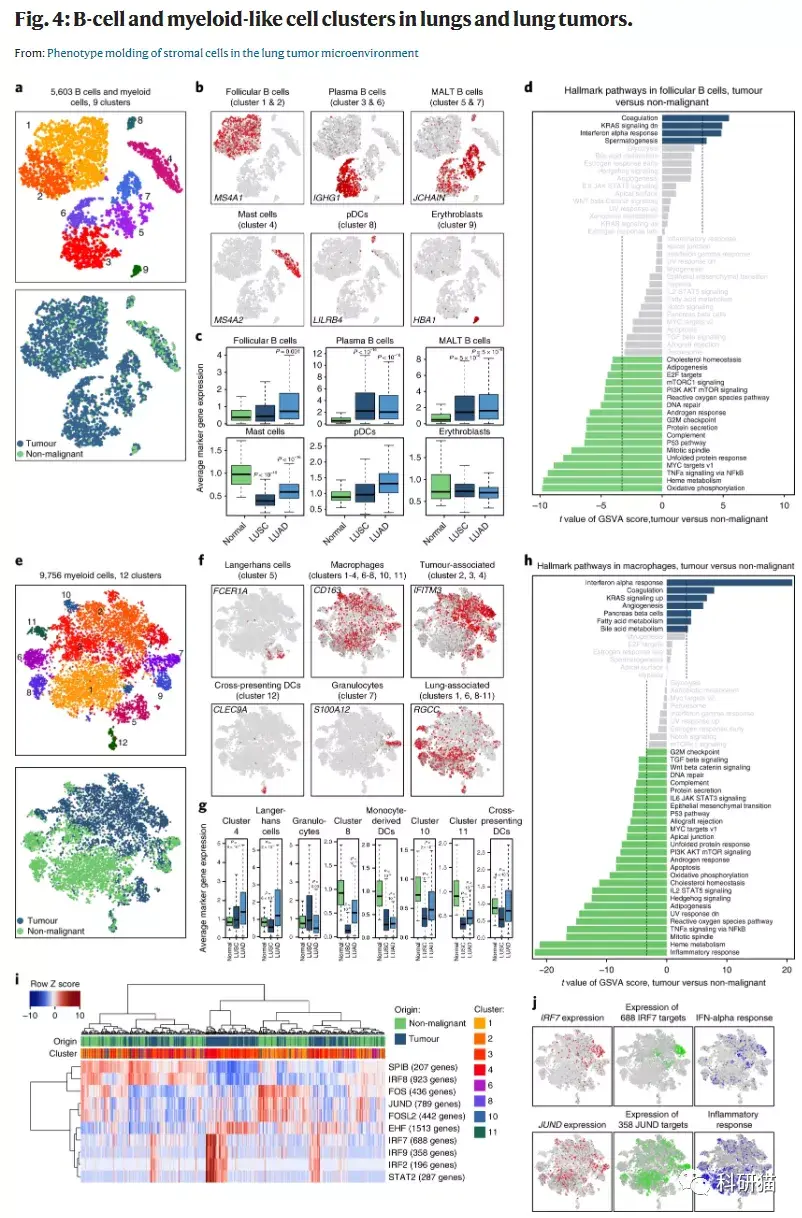
a, 5,603个 B细胞 的tSNE图,按其相关的亚群(上)或来源的样品类型(下)进行颜色注释。
b, tSNE图,按亚群的marker基因的表达(灰色到红色)进行着色。
c, 每个亚群的成纤维细胞的marker基因在来自正常肺(n = 108)、LUSC(n = 501)或LUAD(n = 513)的TCGA样本中平均表达。
d, 通过GSVA对从正常肺部或肺部肿瘤分离的滤泡B细胞(第1和第2群)的通路进行差异分析
e, 9,756个 髓样细胞 的tSNE图,按其相关的亚群(上)或来源的样品类型(下)进行颜色注释。
f, tSNE图,按亚群的marker基因的表达(灰色到红色)进行着色。
g, 每个亚群的髓样细胞的marker基因在来自肺(n = 108)、LUSC(n = 501)或LUAD(n = 513)的TCGA样本中的平均表达量。
h, 通过GSVA对从正常肺部或肺部肿瘤分离的巨噬细胞的通路进行差异分析
i, 每个成纤维细胞亚群之间用SCENIC预测的转录因子表达调节的AUC分数的热图。
j, 巨噬细胞的tSNE图,用颜色注释(左)IRF9和JUND的表达,这些转录因子的预测调节活性的AUC(中)和相关通路的GSVA分数(右)。
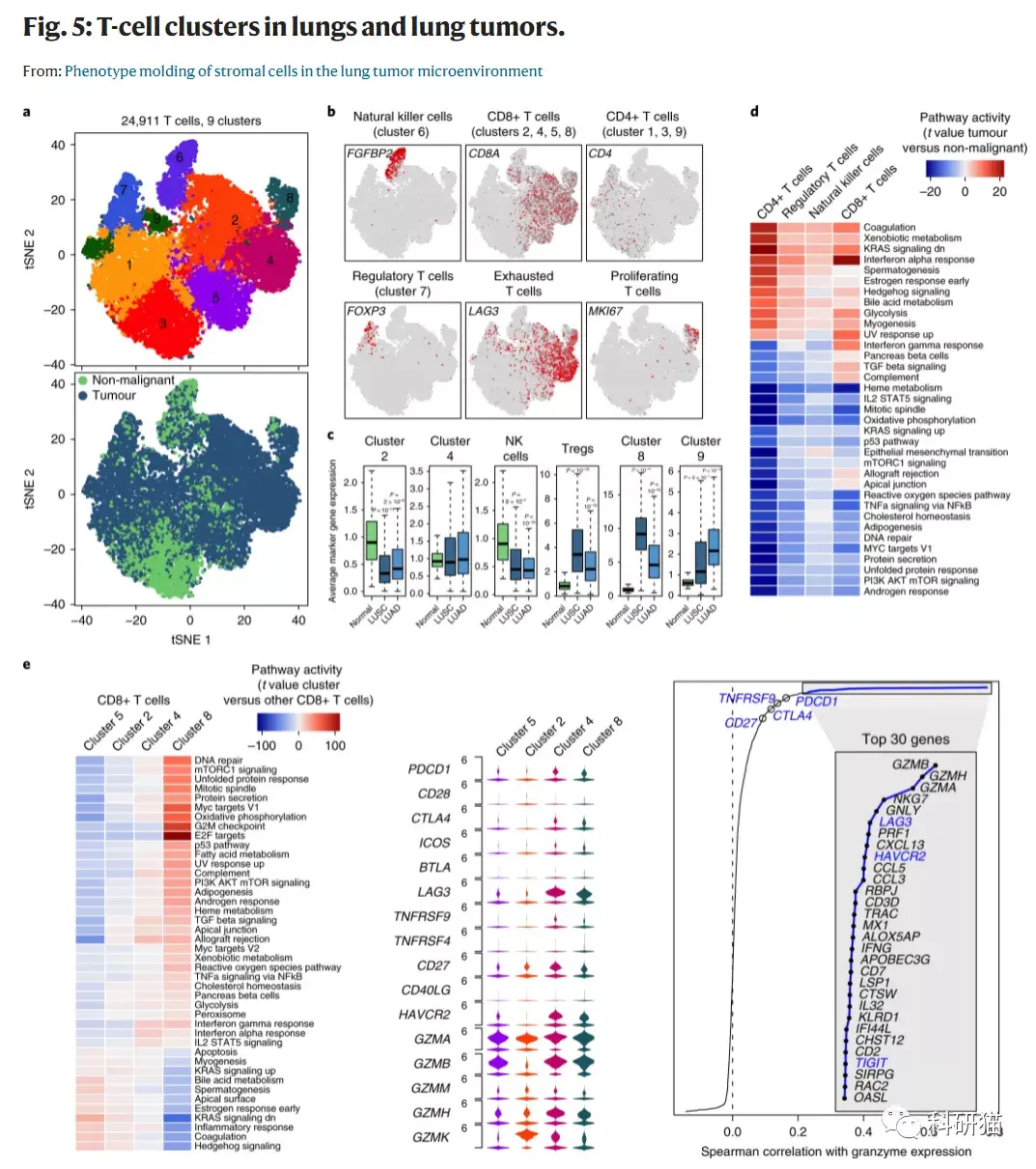
a, 24,911个T细胞的tSNE图,按其相关的亚群(上)或来源的样品类型(下)进行颜色注释。
b, tSNE图,按亚群的marker基因的表达(灰色到红色)进行着色。
c, 每个T细胞亚群的marker基因在来自正常肺(n = 108)、LUSC(n = 501)或LUAD(n = 513)的TCGA样本中的平均表达。
d, 通过GSVA对来源于正常肺部或肺部肿瘤的T细胞的通路进行评分。
e, 与d图一致,对CD8+T细胞的亚群进行评分。
f, 小提琴图显示参与T细胞活性和免疫检查点的特定基因在不同细胞亚群中的表达。
g, 1,704个CD8 T细胞特异性基因(相对于所有其他细胞过量表达>3倍)的表达量与平均颗粒酶表达量(GZMA、GZMB和GZMH)之间的相关性(TOP30)。
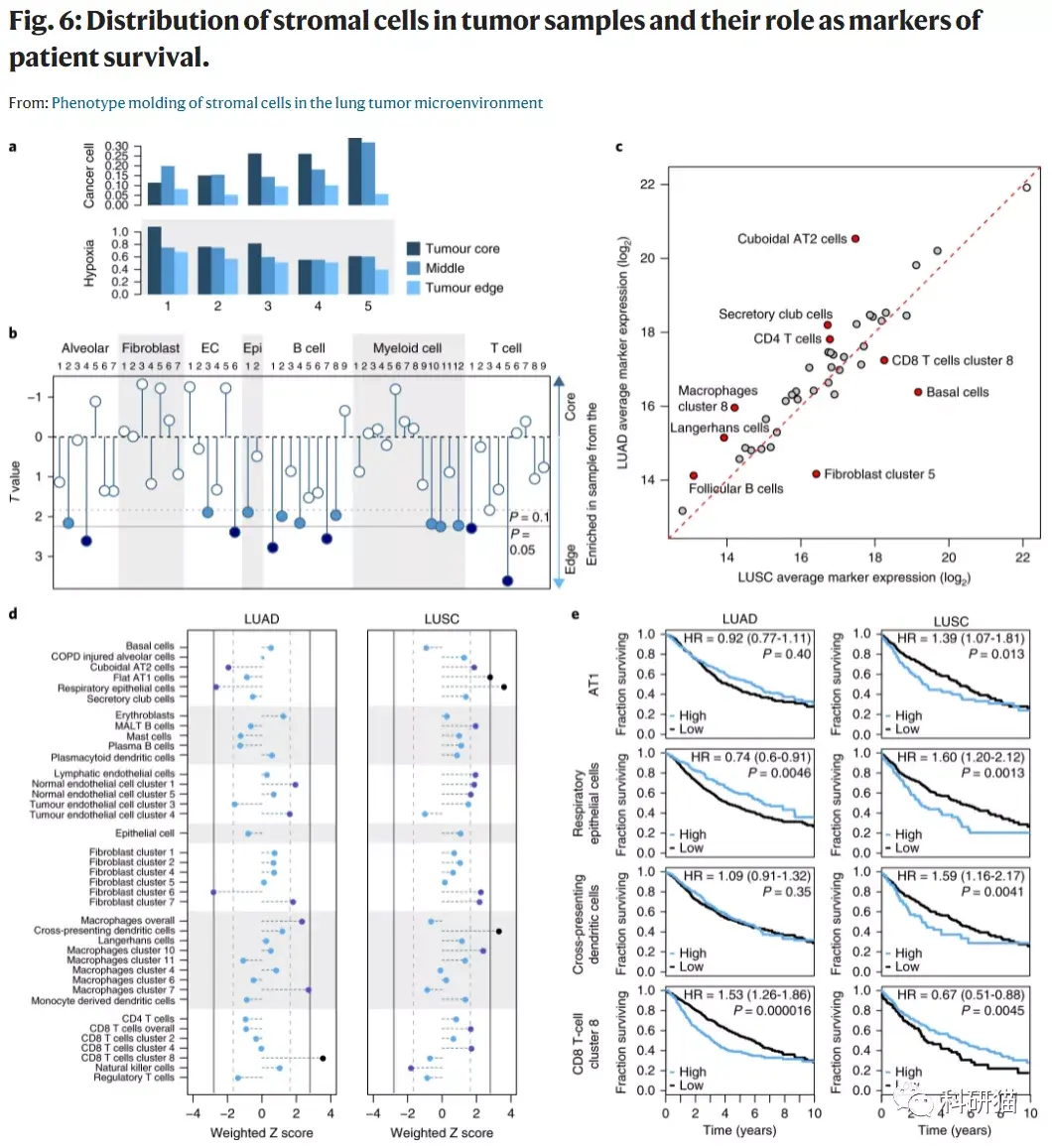
a, 每个肿瘤来源样本的肿瘤细胞分数和缺氧标志物基因表达。本研究包括的五个肿瘤被分成三份,每块都被标记为来源于核心、边缘或中间,介于边缘和核心之间。
b,线性模型的t值,显示肿瘤核心或边缘的基质细胞簇的富集。
c,TCGA-LUAD(n = 501)或LUSC(n = 513)样本中marker基因的平均表达量。
d,1,027个LUAD样本(左)或545个LUSC样本(右)中的marker基因表达(连续)与患者生存率之间的关系。
e,LUAD或LUSC患者(n = 1,027 或 n=545)的Kaplan-Meier生存曲线,根据注释的基质细胞标记基因的平均表达(二分类:高、低)分层。
文章的优点:
这篇文章非常能够代表单细胞研究的特点:
- 单细胞可以分出不同的细胞群,继而可以发现新的细胞亚群;
- 不同细胞亚群的功能之间是否存在不同,是否存在不同的分化状态,哪些基因的表达可以代表不同的细胞状态;
-
不同的细胞亚群和临床表型之间有什么联系?
见贤思齐
那么想要完成这样的研究,需要哪些知识和技能呢?
- 对于研究的背景,要有清楚的认知,哪些做过,哪些没有,哪些做得还不够深入,哪些切入点还探索较少?
- 要有娴熟的数据分析技巧和高超的绘图能力,这也是高分文章的共性,一图胜千言!
-
画出图的前提是要有数据,那么数据从哪里来?第一个自己去做测序,第二个就是使用公开的数据。不管是来源于哪里的数据,一定一定都需要第二点技能的支持。
我们再回过来看一看这篇文献,内容很多

但是仔细阅读一下大家就可以发现,这些都是由几个关键步骤串联起来的,总结一下就是:
- 细胞分群和注释
- 细胞再分亚群
- 不同亚群的功能差异
- 结合临床特征
 什么是mRNA疫苗?
https://www.zhihu.com/video/1413222237655072768
什么是mRNA疫苗?
https://www.zhihu.com/video/1413222237655072768
